Распад сернистой кислоты на воду и SO2 – это химическая реакция, в результате которой молекулы сернистой кислоты распадаются на молекулы воды и диоксида серы. Этот процесс является важным элементом в промышленной и лабораторной химии, поскольку позволяет получать и использовать диоксид серы, который является важным сырьем для различных химических процессов и выпуска газов.
Условия, необходимые для проведения реакции распада сернистой кислоты на воду и SO2, включают наличие готовых реагентов – сернистой кислоты и воды. Кроме того, важно контролировать температуру реакционной среды и используемых веществ, поскольку она определяет скорость процесса и его эффективность. Также влияние на реакцию оказывают концентрация сернистой кислоты, присутствие катализаторов и другие факторы.
Распад сернистой кислоты на воду и SO2 может быть использован в различных областях промышленности, таких как производство удобрений, очистка газовых выбросов, производство красителей и др. Кроме того, из диоксида серы можно получать другие соединения, такие как серная кислота, серный ангидрид и др. Изучение этой химической реакции и ее условий позволяет разрабатывать новые методики и технологии, которые способствуют оптимизации процессов и повышению эффективности промышленного производства.
Распад сернистой кислоты на воду
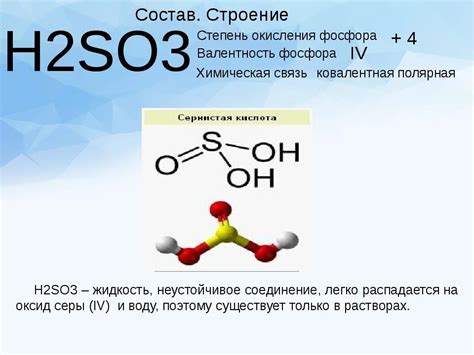
Распад сернистой кислоты на воду происходит при повышенной температуре и в присутствии катализатора, такого как платина или оксид ванадия. Такая реакция обратима и может быть представлена следующим образом:
H2SO3 ⇌ H2O + SO2
Распад сернистой кислоты на воду является важным шагом в процессе производства серной кислоты. Полученный SO2 может быть далее использован для синтеза других химических соединений или при производстве бумаги, виноделии и других отраслях промышленности.
Распад сернистой кислоты на SO2: процесс и условия

Распад сернистой кислоты может произойти под воздействием различных факторов, включая температуру, концентрацию кислоты, присутствие катализаторов и т.д. Наиболее распространенным способом является нагревание сернистой кислоты. Обычно эту реакцию проводят при температуре около 600-750 градусов по Цельсию.
Помимо температуры, на скорость и полноту реакции также могут влиять концентрация сернистой кислоты, наличие примесей и катализаторов. Высокая концентрация кислоты способствует более интенсивному распаду и образованию большего количества SO2. Катализаторы, такие как металлы, могут значительно ускорить реакцию и снизить необходимую температуру для ее проведения.
Распад сернистой кислоты на SO2 является обратимой реакцией, что означает, что SO2 также может реагировать с водой и образовывать сернистую кислоту. Это важно учитывать при планировании стадии обезвоживания и очистки газов, чтобы предотвратить обратную реакцию.
В итоге, распад сернистой кислоты на SO2 является сложным и интенсивно изучаемым химическим процессом. Знание условий, влияющих на эту реакцию, позволяет эффективно контролировать выделение SO2 и принимать меры по его улавливанию и нейтрализации.



