Водород - это самый простой и химически активный элемент в периодической системе. В его самом обычном состоянии, атом водорода несет нейтральный электрический заряд, в котором количество протонов и электронов сбалансировано. Однако, в некоторых условиях, атом водорода может стать положительно заряженным – в таком случае он превращается в положительный ион.
Ионизация атома водорода происходит, когда один или несколько его электронов отрываются от атома и уходят. Это может быть вызвано различными процессами, такими как облучение электромагнитным излучением, столкновение с другими частицами или высокой температурой. Когда это происходит, образуется положительно заряженный ион – атом водорода становится дентифицированным в качестве водородного катиона.
Когда атом водорода теряет один электрон, он превращается в самый обычный водородный катион, обозначаемый как H+. Это означает, что у иона есть только один протон и не имеет нейтральных электронов. Водородные катионы являются нестабильными и очень реактивными частицами, что делает их важными в различных химических и физических процессах, таких как реакции водорода с другими веществами.
Процесс превращения атома водорода в положительный ион

В процессе превращения атома водорода в положительный ион происходит потеря электрона. Атом водорода состоит из одного протона в ядре и одного электрона, обращающегося по орбите вокруг ядра.
Положительный ион водорода, также известный как протон, создается путем отщепления электрона от атома. Это может произойти при взаимодействии с другими атомами или молекулами, когда энергия столкновения превышает энергию ионизации водорода.
Процесс ионизации водорода может происходить под воздействием высоких температур, сильных электрических полей или при взаимодействии с другими заряженными частицами. При этом электрон переходит на более высокую энергетическую орбиту или полностью покидает атом водорода, образуя положительный протон.
Положительные ионы водорода играют важную роль во многих химических и физических процессах. Они могут взаимодействовать с другими молекулами и ионами, участвовать в химических реакциях и образовании соединений.
Атом водорода
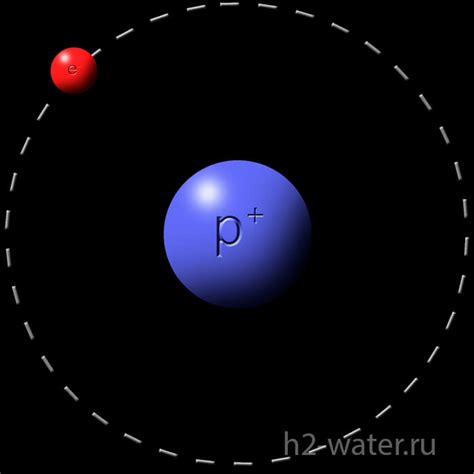
Однако, под воздействием различных факторов, атом водорода может приобрести положительный заряд. Это происходит, когда электрон отделяется от атома и движется в другую область. В результате атом остается с одним протоном и без электрона, становясь положительно заряженным ионом.
Появление положительно заряженного иона водорода может происходить в различных условиях. Например, при повышенной температуре или при действии электрического поля. Также, положительный ион водорода может образовываться при химических реакциях, когда атомы водорода отдают свои электроны другим элементам.
Положительно заряженный ион водорода имеет важное значение в различных научных и промышленных областях. Например, он используется в электрохимии, спектроскопии и плазменной физике. Также, положительные ионы водорода могут быть использованы для создания искусственной плазмы и в процессах синтеза новых материалов.
Ионизация атома

Когда атом водорода получает энергию из внешнего источника, его электроны переходят на более энергетические уровни и временно остаются там. При возвращении электроны на исходные уровни атом избавляется от избыточной энергии, излучая фотоны. Однако, в некоторых случаях, атом водорода может потерять электрон окончательно, вызвав ионизацию.
Ионизация атома водорода может происходить под воздействием различных факторов, включая высокие температуры, электрические разряды или световое излучение. При этом, образовавшийся положительный ион водорода может вступать в реакции с другими атомами или молекулами, изменяя химические свойства вещества.
Ионизация атома водорода имеет широкое применение в различных научных областях, включая астрономию, атомную физику и химию. Изучение этого процесса позволяет понять основные принципы строения и взаимодействия атомов и молекул, а также разрабатывать новые материалы и технологии.
Отрыв электрона

Электроны являются негативно заряженными частицами, находящимися вокруг ядра атома. Они образуют электронную оболочку и привлекаются к положительно заряженному ядру силой электростатического притяжения. Однако в некоторых случаях энергия, передаваемая внешним воздействием, может быть достаточно большой, чтобы позволить электрону преодолеть электростатическое притяжение и покинуть атом.
Отрыв электрона может происходить под воздействием различных физических процессов, таких как нагревание, освещение или воздействие электрического поля. При этом электрон получает достаточно энергии для преодоления сил притяжения ядра и покидает атом.
После отрыва электрона, атом водорода становится положительно заряженным, поскольку количество протонов в ядре остается неизменным, а количество электронов уменьшается. Положительно заряженные ионы водорода могут взаимодействовать с другими частицами, образуя химические соединения или участвуя в реакциях.
Отрыв электрона в атоме водорода является важным процессом в различных областях физики и химии. Он может быть использован для исследования структуры и свойств атомов, а также в промышленности, например, при синтезе различных химических соединений.
Образование положительного иона
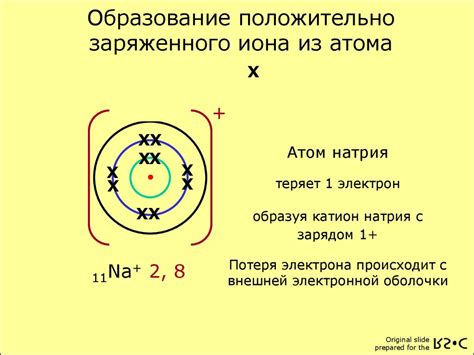
Положительный ион водорода, также известный как протон, образуется, когда атом водорода теряет свой единственный электрон. Этот процесс может происходить под воздействием различных факторов, таких как высокая температура, высокое давление или взаимодействие с другими химическими веществами.
Когда атом водорода теряет свой электрон, он становится положительно заряженным, поскольку его протоны (положительно заряженные частицы) остаются в ядре, а его электроны (отрицательно заряженные частицы) удаляются.
Образование положительного иона водорода является процессом, обратным процессу ионизации, когда водородный атом приобретает дополнительный электрон и становится отрицательно заряженным. Положительные ионы, такие как положительный ион водорода, играют важную роль в различных химических реакциях и процессах, а также имеют значительное значение в области физики и астрофизики.
Заряд положительного иона
Когда атом водорода теряет один электрон и становится положительным ионом, его заряд становится положительным. Внешний электронный оболочка полностью утрачивается, оставляя только протон в ядре атома и электронные области без электронов. Положительный заряд иона изначально равен одному элементарному заряду, величине заряда одного протона.
Протон - это один из основных элементарных частиц, которая находится в ядре атома. Он обладает положительным зарядом и массой, примерно равной массе нейтрона.
Заряд положительного иона влияет на его химические и физические свойства. Ионы с положительным зарядом имеют тенденцию образовывать химические соединения с другими атомами и ионами, чтобы компенсировать свой избыточный положительный заряд. Это делает положительные ионы значительно более реактивными, чем нейтральные атомы.
Свойства положительных ионов водорода

Положительные ионы водорода, обозначаемые H+, играют важную роль во многих химических реакциях и естественных процессах. Они обладают рядом уникальных свойств, которые определяют их поведение и взаимодействие с другими веществами.
Во-первых, положительные ионы водорода имеют высокую электрофильность, что означает, что они активно привлекают электроны. Это свойство делает их хорошими донорами протонов в реакциях кислотно-основного нейтрализации.
Во-вторых, положительные ионы водорода обладают очень маленьким размером и массой, что позволяет им проникать через мембраны и проникать внутрь клеток. Это свойство делает их важными для регулирования рН внутриклеточной среды и метаболических процессов.
Также положительные ионы водорода могут образовывать химические связи с другими атомами, такими как кислород или азот. Это позволяет им участвовать в образовании молекул, таких как вода или аммиак.
Наконец, положительные ионы водорода обладают значительной энергией, что позволяет им участвовать в химических реакциях, таких как окисление или восстановление. Они также могут быть использованы в электрохимических процессах, таких как электролиз.
В целом, положительные ионы водорода играют важную роль во многих физических и биологических процессах. Их свойства определяют их функцию и значимость в химии и жизни.
Возникновение положительных ионов в природе

Положительные ионы, включая ионы водорода, играют важную роль во многих процессах природы. Возникновение положительных ионов происходит в результате различных химических и физических процессов.
Один из примеров возникновения положительных ионов в природе - процесс ионизации атомов при воздействии электромагнитного излучения от Солнца. В высших слоях атмосферы, где концентрация молекул газов невысока, ультрафиолетовое излучение Солнца способно столкнуть электроны с атомами, образуя положительные ионы. Результатом этого процесса является образование ионосферы, состоящей в основном из положительных ионов водорода и кислорода.
Другой важный процесс, приводящий к возникновению положительных ионов, - фотоэлектрический эффект. При воздействии света на поверхность вещества энергия фотонов может быть поглощена атомами, что приводит к вылету электронов. В результате этих реакций образуются положительные ионы вещества.
Также положительные ионы могут возникать в результате химических реакций. Например, в процессе окисления металлов или взаимодействия кислорода с другими веществами образуются положительные ионы. Такие реакции часто происходят в природе, например, при горении древесины или разложении органических веществ.
Возникновение положительных ионов в природе имеет важное значение для многих процессов, таких как образование озонового слоя, электрических разрядов, образование молекул и газов в атмосфере. Понимание этих процессов является важным шагом в изучении природы и ее взаимодействия с окружающей средой.



