Растворы электролитов – это основа для многих химических реакций и процессов. Они играют важную роль в таких областях как химия, биология, экология и даже повседневная жизнь. Но какие условия определяют, протекает ли реакция до конца или нет? В этой статье мы рассмотрим ключевые факторы, влияющие на степень протекания реакций в растворах электролитов.
Один из основных факторов, определяющих степень протекания реакции, – это концентрация электролита в растворе. Чем выше концентрация, тем больше ионов присутствует в растворе, и тем больше возможных столкновений для реакции. При достаточно высокой концентрации электролита, реакция может идти до конца, полностью превращая все исходные вещества в продукты. Однако низкая концентрация электролита может вызвать неоконченную реакцию, когда только часть исходных веществ превращается в продукты.
Еще одним фактором, влияющим на степень прохождения реакции, является реакционная равновесие. Реакционное равновесие определяет, в каком направлении будет протекать реакция и в какой степени она будет проходить до конца. Если реакция достигнет равновесия, то количество превращенных исходных веществ и продуктов будет постоянным. Однако, если равновесие смещено в одну сторону, реакция может протекать до конца, полностью превращая все исходные вещества в продукты.
Реакции в растворах электролитов
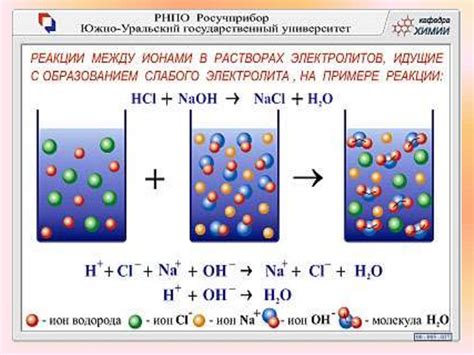
Полные реакции в растворах электролитов называются концентрированными или стехиометрическими реакциями. В таких реакциях все ионы электролита участвуют в химической реакции и реагенты полностью переходят в продукты. Например, реакция между хлоридом натрия и серной кислотой:
- NaCl + H2SO4 → Na2SO4 + HCl
Частичные реакции в растворах электролитов называются неполными реакциями, так как ионы электролита не полностью участвуют в химической реакции. Неполные реакции характерны для слабых электролитов, чья степень ионизации невелика. Например, реакция между уксусной кислотой и водой:
- CH3COOH + H2O ⇌ CH3COO- + H3O+
В данном случае уксусная кислота является слабым электролитом, поэтому ее молекулы частично ионизируются, образуя ионы ацетата и гидроксония.
Знание степени ионизации электролита позволяет предсказать, какие реакции будут протекать до конца, а какие будут неполными. Это имеет значение при проведении химических реакций и в процессе решения химических задач.
Протекают до конца

Реакции в растворах электролитов протекают до конца, когда все ионы электролита полностью превращаются в продукты реакции. Это происходит только при условии, что реакция происходит в достаточно растворе электролита, где ионы полностью диссоциируют.
В растворе электролита ионы разделяются и свободно перемещаются по раствору. При наличии других веществ, способных участвовать в реакции, происходит образование новых соединений. Реакции в растворах электролитов могут быть обратимыми или непрерывными, в зависимости от условий среды.
Протекание реакции до конца обеспечивается различными факторами, включая концентрацию электролита, температуру, наличие катализаторов и других реагентов. При повышенной концентрации электролита и благоприятных условиях реакции, большая часть электролита диссоциирует и реакция протекает до конца.
| Фактор | Влияние на протекание реакции до конца |
|---|---|
| Концентрация электролита | Повышение концентрации электролита приводит к большей диссоциации и протеканию реакции до конца. |
| Температура | Повышение температуры обычно ускоряет реакцию и способствует ее протеканию до конца. |
| Катализаторы | Наличие катализаторов может ускорить реакцию и обеспечить ее протекание до конца. |
| Другие реагенты | Наличие дополнительных реагентов может способствовать протеканию реакции до конца. |
Протекание реакций до конца в растворах электролитов играет важную роль в области химической кинетики и химического равновесия. Понимание факторов, влияющих на протекание реакций до конца, позволяет контролировать и оптимизировать химические процессы в различных областях науки и промышленности.
Когда происходит ионизация
В растворах электролитов ионизация происходит, когда электролит полностью диссоциирует в растворе на ионы. Это означает, что все молекулы электролита расщепляются на положительно и отрицательно заряженные ионы, которые становятся свободными и могут перемещаться в растворе.
Процесс ионизации обычно происходит при воздействии на электролит водой или другим растворителем. Вода является хорошим растворителем для большинства электролитов, и поэтому ионизация происходит довольно быстро и эффективно. Однако, некоторые электролиты также могут ионизироваться при повышенной температуре.
Например, соль натрия (NaCl) ионизируется в водном растворе по следующему уравнению:
NaCl → Na+ + Cl-
Таким образом, ионизация реакции происходит, когда все молекулы электролита полностью расщепляются на ионы, что позволяет проводить ток через раствор и вызывает химические изменения.
Условия ионизации реакций
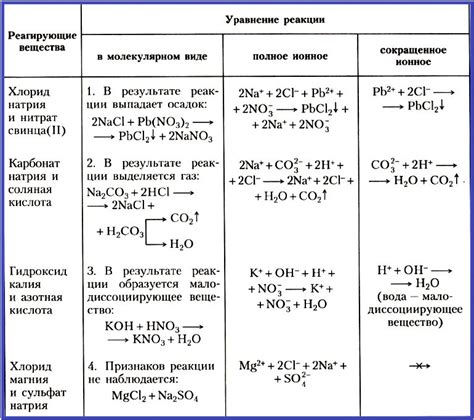
Ионизация реакций в растворах электролитов может проходить до конца или не до конца в зависимости от ряда факторов, таких как концентрация электролита, температура и физические свойства раствора. Важно понимать эти условия, чтобы правильно интерпретировать реакции в растворах и предсказывать их результаты.
1. Концентрация электролита: Реакции в растворах электролитов могут проходить до конца, если концентрация электролита достаточно высока. Высокая концентрация электролита обеспечивает большое количество ионов, что способствует большой скорости ионизации и диссоциации, и реакция может протекать полностью.
2. Температура: Повышение температуры может стимулировать ионизацию реакций. Высокая температура обеспечивает энергию, необходимую для преодоления энергетического барьера реакции. При этом реакция может проходить до конца.
3. Физические свойства раствора: Вязкость ионного раствора, диэлектрическая проницаемость, наличие других растворителей и примесей также могут влиять на ионизацию реакции. Некоторые растворители или примеси могут замедлить или вовсе препятствовать ионизации, а некоторые могут её ускорить.
Важно отметить, что некоторые реакции могут не проходить до конца даже при оптимальных условиях. Влияние всех факторов, таких как термодинамические и кинетические особенности реакции, должно быть учтено при изучении ионизации реакций в растворах электролитов.
Факторы, влияющие на степень ионизации

Степень ионизации реакций в растворах электролитов зависит от нескольких факторов:
| 1. Концентрация электролита | Чем выше концентрация раствора электролита, тем больше ионов образуется и тем выше будет степень ионизации реакции. Это объясняется тем, что чем больше электролита растворено в растворе, тем больше столкновений происходит между ионами и водными молекулами, что способствует их диссоциации. |
| 2. Температура | Увеличение температуры приводит к увеличению степени ионизации. Это происходит из-за увеличения энергии частиц вещества при нагревании. Более высокая энергия обеспечивает большую активность ионов, что способствует их отделению от молекул электролита. |
| 3. Размер и заряд ионов | Ионы маленького размера и с большим зарядом обладают большей степенью ионизации. Это связано с тем, что ионы маленького размера имеют большую скорость и аномальную подвижность. Ионы с большим зарядом также имеют большую миграционную способность и поэтому легче отделяются от других ионов в растворе. |
| 4. Полярность растворителя | Если растворитель является полярным, то эта полярность способствует диссоциации электролита и связыванию ионов. В результате степень ионизации будет выше, так как полярные молекулы растворителя оказывают большую силу на ионы, расщепляющиеся. |
Учет этих факторов позволяет понять и объяснить, почему ионизация реакций в растворах электролитов может быть полной или неполной.
Роль солей в реакциях
Во-первых, соли могут быть использованы как реагенты в химических реакциях. Они могут быть ионными или молекулярными, и их свойства определяются ионами, которые они содержат. Например, соль нитрата меди (II), Cu(NO3)2, можно использовать в реакции, чтобы получить осадок нитрата серебра, AgNO3:
Cu(NO3)2 + 2AgNO3 → Cu(NO3)2 + 2Ag
Во-вторых, соли могут служить катализаторами реакций. Катализаторы ускоряют скорость химических реакций, не участвуя в них. Например, соль, содержащая металлическую компоненту, может ускорить реакцию окисления-восстановления. Катализаторы могут формировать временные связи с реагентами, снижая энергию активации, необходимую для протекания реакции.
В-третьих, соли могут выступать в роли стабилизаторов реакций. Они способны сохранять стабильность реагентов и продуктов реакции, предотвращая их разложение или другие побочные реакции. Например, некоторые соли могут повысить стабильность ионов в растворе, увеличивая их концентрацию.
Таким образом, соли играют важную роль в реакциях, обладая свойствами реагентов, катализаторов и стабилизаторов одновременно. Изучение и понимание их роли помогает расширить наши знания о химических реакциях и их механизмах.
Важная информация о реакциях в растворах электролитов
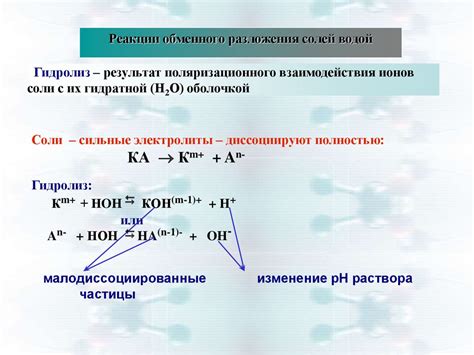
Реакции в растворах электролитов протекают до конца, когда ионные соединения полностью диссоциируются на ионы. Это означает, что молекулы электролита распадаются на положительные и отрицательные ионы, которые свободно перемещаются в растворе.
Полная диссоциация электролита происходит только в случае ионного соединения или сильного электролита, такого как соли или кислоты с высокой степенью ионизации. Например, хлорид натрия (NaCl) полностью диссоциирует на ионы натрия (Na+) и хлора (Cl-).
В то же время, слабые электролиты, такие как уксусная кислота или аммиак, диссоциируются частично, образуя лишь небольшое количество ионов в растворе. Это связано с тем, что слабые электролиты имеют невысокую степень ионизации.
Реакции в растворе электролита могут также протекать до конца при наличии растворимых газов. Например, растворение газа в воде приводит к формированию ионов или молекул, которые могут реагировать с другими соединениями в растворе.
- Реакции в растворах электролитов до конца инициируются в случае полной диссоциации электролита;
- Слабые электролиты диссоциируются частично;
- Наличие растворимых газов в реакциях также может привести к полному ходу реакции.



