Серная кислота – важное химическое соединение, которое обладает сильно коррозионной активностью и широко используется в различных отраслях промышленности. Ее реакция с водой является одной из наиболее известных химических реакций.
Когда серная кислота встречается с водой, происходит процесс, называемый гидратация. В результате этой реакции образуется сероводородная кислота и высвобождаются значительные объемы теплоты. При контакте с водой, также могут образовываться сернистая кислота и серная кислота в газообразном состоянии.
Характеристика реакции: реакция серной кислоты с водой является экзотермической (выделяет тепло) и реактивной. При этом, серная кислота действует на воду настолько активно, что контакт с ней может вызывать ожоги на коже и слизистых оболочках. Серная кислота также обладает высокой концентрацией протонов, что делает ее одним из самых кислых веществ, которые обычно встречаются в химической лаборатории.
Особенностью реакции серной кислоты с водой является также возможность обратного процесса – выделения серной кислоты из ее солей или эстеров. Это обратная реакция называется дегидратацией. Она часто используется в химической промышленности для получения высокой концентрации серной кислоты.
Свойства и особенности реакции серной кислоты с водой
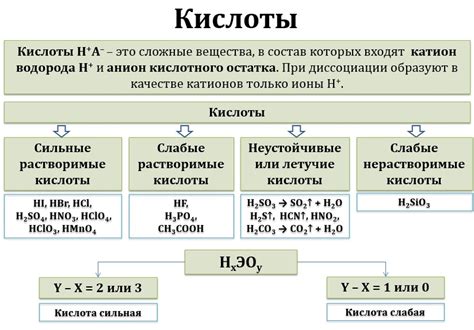
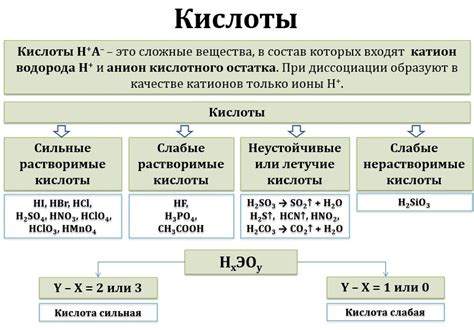
Основные свойства реакции между серной кислотой и водой включают:
1. Эндотермическая реакция: Реакция серной кислоты с водой является эндотермической, то есть она поглощает тепло от окружающей среды. Это может быть наблюдаемо через повышение температуры реакционной смеси.
2. Выделение тепла: Хотя реакция является эндотермической, она также сопровождается выделением значительного количества тепла. Это связано с выделением энергии при образовании новых химических связей.
3. Образование серной кислоты: При реакции серной кислоты с водой образуется серная кислота. Это одно из наиболее важных химических соединений, используемых в промышленности и научных исследованиях.
4. Оксидационные свойства: Серная кислота обладает сильными оксидационными свойствами. Реакция с водой позволяет серной кислоте окислиться и принять на себя электроны, что вызывает образование серного оксида и водорода.
5. Концентрированная кислота: Реакция между серной кислотой и водой происходит особенно быстро при использовании концентрированной серной кислоты. Это связано с высокой активностью и реакционной способностью концентрированной кислоты.
Важно отметить, что реакция серной кислоты с водой является очень опасной и должна проводиться с особым вниманием и предосторожностью. Контроль температуры, использование защитного снаряжения и применение особых мер предосторожности являются необходимыми условиями при работе с этой реакцией.
Ионизация и протолитическая реакция

Серная кислота, H2SO4, является двухосновной кислотой, что означает, что в одной молекуле кислоты присутствуют два протонно-активных водорода. При взаимодействии с водой один из этих водородов отщепляется и переходит на молекулы воды, образуя ионы водорода H+.
Ионы водорода в растворе реагируют с водными молекулами, ионизируя их. В результате образуются ионы гидроксида OH-. Таким образом, реакция ионизации серной кислоты с водой приводит к образованию ионов H+ и OH-. Эти ионы обладают электрическим зарядом и делают раствор серной кислоты электролитически активным.
Протолитическая реакция серной кислоты в воде сопровождается образованием ионов водорода (H+) и ионов гидроксида (OH-). Протолитическая реакция является обратимой, поэтому ионы водорода и ионы гидроксида в растворе существуют как вещества в водной форме.
Энергетика реакции
Энергетическая ценность реакции серной кислоты с водой обусловлена ее высокой степенью диссоциации и эндотермической реакцией образования серной кислоты. При этом образующаяся серная кислота может быть использована в химической промышленности для производства различных продуктов, таких как удобрения и сульфаты металлов.
Однако, наиболее распространенным способом использования энергии, выделяемой при реакции серной кислоты с водой, является производство электроэнергии. Так называемые термоэлектрические станции используют эту реакцию для нагрева воды и преобразования полученного пара в механическую энергию, которая затем преобразуется в электроэнергию с помощью турбин и генераторов. Это позволяет получить значительное количество энергии для использования в бытовых и промышленных нуждах.
Такие способы использования энергии, выделяемой при реакции серной кислоты с водой, являются эффективными и применяются в различных регионах мира. Однако, необходимо также учитывать, что данная реакция сопровождается выделением значительного количества тепла, что может приводить к экологическим проблемам, связанным с увеличением уровня загрязнения атмосферы и водных систем. Поэтому, важно разрабатывать и внедрять инновационные технологии, которые помогают минимизировать негативные последствия энергетики реакции серной кислоты с водой.
| Преимущества | Недостатки |
|---|---|
| Высокая энергетическая ценность реакции | Возможные экологические проблемы |
| Возможность производства электроэнергии | |
| Использование в промышленности |
Образование сульфатных и гидроксильных ионов

При реакции серной кислоты с водой происходит образование сульфатных и гидроксильных ионов. Серная кислота (H2SO4) разлагается на два иона в растворе: H+ и SO42-. Гидроксид ион (OH-) образуется от воды (H2O), которая диссоциирует на ионы водорода (H+) и гидроксидные ионы (OH-).
Соединение серы (SO42-) в растворе серной кислоты образует сульфатные ионы. Сульфатные ионы имеют отрицательный заряд и являются анионами. Они взаимодействуют с другими ионами и могут образовывать ряд соединений, таких как сульфаты различных металлов.
Гидроксильные ионы (OH-) являются основными частицами, которые образуются при диссоциации воды. Они имеют отрицательный заряд и являются основными ионами гидролиза. Гидроксильные ионы могут реагировать с другими ионами, образуя гидроксиды различных металлов и соли.
Таким образом, реакция серной кислоты с водой приводит к образованию сульфатных и гидроксильных ионов, которые играют важную роль в химических реакциях и образовании различных соединений.
Кислотно-основные свойства серной кислоты

При контакте с водой, серная кислота энергично реагирует, образуя гидроксонийные (H₃O⁺) и сульфатные (HSO₄⁻) ионы. Эта реакция иллюстрирует кислотные свойства серной кислоты:
| Реакция | Уравнение |
|---|---|
| Диссоциация в водных растворах | H₂SO₄ + H₂O → H₃O⁺ + HSO₄⁻ |
| Реакция с щелочами | H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O |
| Взаимодействие с металлами | H₂SO₄ + 2Na → Na₂SO₄ + H₂ |
| Образование солей | H₂SO₄ + Ca(OH)₂ → CaSO₄ + 2H₂O |
Серная кислота также может действовать как основание, реагируя с сильными кислотами, такими как серной или хлорной кислоты, и образуя соли. Например:
H₂SO₄ + HCl → H₂S₂O₇
Таким образом, кислотно-основные свойства серной кислоты определяют ее активность и широкий спектр реакций с различными веществами.
Физические изменения среды

При реакции серной кислоты с водой происходят физические изменения среды, которые отражаются на ее свойствах и внешнем виде.
| Свойства и изменения | Описание |
|---|---|
| Температура | При смешении серной кислоты с водой происходит значительное выделение тепла, что приводит к повышению температуры реакционной среды. |
| Цвет | Реакция серной кислоты с водой не сопровождается изменением цвета реагентов или образованием новых окрашенных веществ. |
| Фазовое состояние | Серная кислота и вода находятся в разных фазовых состояниях. Серная кислота представляет собой жидкость, а вода - также жидкость в нормальных условиях. |
| Прозрачность | Реакционная смесь, полученная при смешении серной кислоты с водой, обычно сохраняет прозрачность и становится мутной только в случае образования осадка или растворения других веществ. |
| Запах | Серная кислота обладает характерным едким запахом, а вода - беззапашной жидкостью. При смешении запах серной кислоты может усиливаться, но при этом запах воды обычно не изменяется. |
Таким образом, реакция серной кислоты с водой вызывает значительные физические изменения в среде, включая повышение температуры, образование мутности и изменение запаха. Эти изменения могут быть важными факторами при проведении химических исследований или практическом использовании серной кислоты.
Влияние концентрации и температуры на скорость реакции
Скорость реакции между серной кислотой и водой зависит от их концентрации и температуры.
Концентрация серной кислоты и воды влияет на количество реагирующих частиц, что прямо влияет на вероятность и скорость столкновения между ними. Повышение концентрации обычно приводит к увеличению скорости реакции, так как реагенты находятся ближе друг к другу и имеют больше возможностей для взаимодействия.
Температура также сильно влияет на скорость реакции. Повышение температуры увеличивает среднюю кинетическую энергию частиц, что ведет к более частым и энергичным столкновениям. Это ускоряет химические реакции, включая реакцию серной кислоты с водой.
Изменение концентрации и температуры могут влиять на равновесие реакции и направление химических превращений. Например, при повышении концентрации серной кислоты или понижении температуры, равновесие реакции сместится в сторону образования большего количества молекул серной кислоты.
Исследования показывают, что реакция между серной кислотой и водой является экзотермической, то есть выделяется тепло. Поэтому повышение температуры может также сказаться на нагреве среды, в которой происходит реакция.
- Увеличение концентрации обычно повышает скорость реакции.
- Повышение температуры также ускоряет реакцию.
- Изменение концентрации и температуры может влиять на равновесие реакции.
- Реакция между серной кислотой и водой является экзотермической.
Практическое применение реакции серной кислоты с водой
Реакция серной кислоты с водой имеет широкое практическое применение в различных отраслях науки и промышленности.
Производство удобрений:
Серная кислота является основной сырьевой компонентой при производстве различных типов удобрений, таких как аммонийный сульфат и моноаммонийный фосфат. В процессе реакции с серной кислотой вода вступает в реакцию с соответствующими соединениями, образуя удобрения, которые используются для повышения плодородия почвы.
Очистка отработанных газов:
Возникновение серных соединений в отработанных газах может быть проблемой для промышленных предприятий. Реакция серной кислоты с водой используется для эффективной очистки отработанных газов от серных соединений. При этой реакции серные соединения превращаются в более безопасные соединения.
Производство бумаги:
Серная кислота играет важную роль в процессе производства бумаги. Разведенная серная кислота используется для обработки древесины, что помогает полностью удалить лининоцеллюлозные волокна и получить чистую целлюлозу. Такая очистка позволяет производить бумагу высокого качества.
Металлургия:
Реакция серной кислоты с водой применяется в металлургии для удаления оксидных пленок с поверхности металлических изделий перед их обработкой. Процесс, который называется декапаж, улучшает адгезию между металлом и покрытием, что повышает качество обработки поверхности.
Важно знать, что реакция серной кислоты с водой является реакцией сильного окислителя и должна проводиться с осторожностью с использованием соответствующей защитной экипировки.



