Серная кислота, также известная как сульфатная кислота, является одним из самых распространенных химических соединений, используемых в промышленности. Относительно высокая концентрация серной кислоты в природе, а также ее значительное использование в процессах производства, делают ее объектом научного интереса.
Серная кислота, будучи двухпротонной кислотой, обладает способностью диссоциировать в два шага. Это означает, что только часть молекул серной кислоты переходит в ионы в растворе. Первый шаг диссоциации включает потерю одного протона, а второй шаг - потерю второго протона.
Диссоциация серной кислоты происходит с поглощением тепла. Уравнения реакций диссоциации можно записать следующим образом:
H2SO4 → H+ + HSO4-
HSO4- → H+ + SO42-
Диссоциация серной кислоты является обратимым процессом, в котором гидрониумные и анионные формы серной кислоты могут реагировать между собой, образуя молекулы недиссоциированной кислоты. Это явление называется обратной диссоциацией.
Изучение ступенчатой диссоциации серной кислоты имеет большое значение в различных областях науки и промышленности. Улучшение понимания этой химической реакции позволяет улучшить процессы производства и оптимизировать применение серной кислоты в различных областях, включая производство удобрений, горнодобывающую промышленность и производство бумаги.
Sерная кислота и ее свойства

Сильная кислотность
Серная кислота является сильным диссоциатом, что означает, что она полностью распадается на ионы при контакте с водой. Это делает ее одной из наиболее кислотных веществ, доступных в химии.
Коррозионные свойства
Серная кислота обладает очень сильным коррозионным действием. Она может разлагать многие вещества, в том числе металлы и органические соединения. Это свойство используется в различных процессах, таких как очистка металлов от окислов и отжиг металлических поверхностей перед нанесением покрытий.
Улавливание воды
Серная кислота является гигроскопичной, то есть она способна активно поглощать воду из окружающей среды. Это свойство делает ее полезной в процессах сушки и концентрирования различных веществ.
Химические реакции
Серная кислота может претерпевать различные химические реакции, что делает ее универсальным реагентом. Она может быть использована в процессах окисления, нейтрализации, эфирных синтезов и т.д.
Важно помнить, что серная кислота является очень опасным веществом и требует особой осторожности при обращении.
Понятие о серной кислоте

Серная кислота широко используется в промышленности для производства различных химических соединений, а также в батареях и аккумуляторах. Кроме того, она является важным реагентом в многих химических реакциях и процессах.
Серная кислота обладает сильными диссоциативными свойствами, то есть она способна разлагаться на ионы в водном растворе. При диссоциации молекула серной кислоты распадается на два иона водорода (H+) и один ион сульфата (SO4^2-). Эти ионы являются основными составляющими активности и реакционной способности серной кислоты.
Диссоциация серной кислоты может происходить ступенчато, то есть в несколько этапов. Сначала происходит частичная диссоциация, при которой лишь небольшая часть молекул серной кислоты переходит в ионы, а затем при дальнейшем разбавлении или нагревании происходит полная диссоциация.
Знание понятия о серной кислоте является важным для понимания многих химических процессов и реакций, а также для применения ее в промышленности и научных исследованиях. Важно помнить, что серная кислота является сильной кислотой и обладает высокой реакционной способностью, поэтому необходимо соблюдать особые меры предосторожности при ее использовании.
Структура и формула серной кислоты
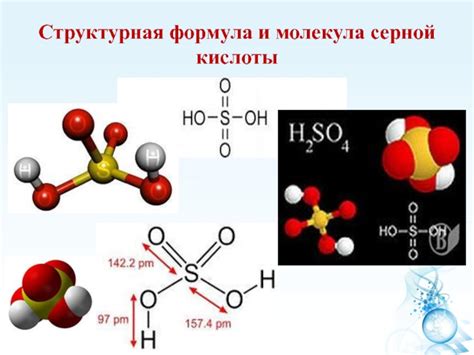
Структура серной кислоты представляет собой два радикала сульфоновой группы (-SO3H), связанных с центральным атомом серы. Вода и молекулярная сера тесно связаны друг с другом и характеризуются высокой степенью полярности.
В отношении диссоциации, серная кислота является сильным двухосновным кислотным соединением. Это означает, что она может отдавать один или оба атома водорода в водную среду, образуя соответственно гидрогенсульфатные (HSO4-) и сульфатные (SO42-) ионы.
Диссоциация серной кислоты

При контакте с водой серная кислота диссоциирует на ионы водорода (H+) и сульфатные ионы (SO42-). Этот процесс происходит ступенчато:
- Первичная диссоциация:
- H2SO4 ⇌ H+ + HSO4-
- Вторичная диссоциация:
- HSO4- ⇌ H+ + SO42-
Таким образом, серная кислота может отдавать до двух протонов в водном растворе и образовывать сульфатные ионы.
Диссоциация серной кислоты имеет значительное значение в химических реакциях и влияет на ее свойства и реакционную способность. Она является одной из основных характеристик этого вещества и определяет его использование в различных областях науки и промышленности.
Механизм диссоциации серной кислоты
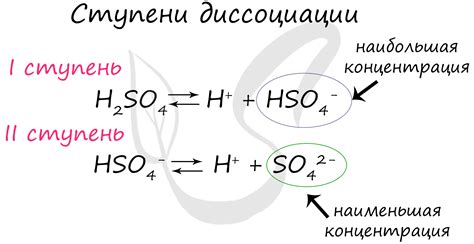
1. Ступень диссоциации:
Первая ступень диссоциации кислоты представляет собой образование гидроксония (H₃O⁺) и бисульфат-иона (HSO₄⁻). Эта реакция представлена уравнением:
H₂SO₄ + H₂O → H₃O⁺ + HSO₄⁻
2. Ступень диссоциации:
Вторая ступень диссоциации серной кислоты происходит между бисульфат-ионами и водными молекулами, образуя гидроксоний (H₃O⁺) и сульфат-ион (SO₄²⁻). Уравнение реакции можно записать следующим образом:
HSO₄⁻ + H₂O → H₃O⁺ + SO₄²⁻
Таким образом, диссоциация серной кислоты происходит шаг за шагом, образуя гидроксоний и соответствующие ионы кислоты.
Свойства серной кислоты
1. Диссоциация:
Серная кислота (H2SO4) диссоциирует ступенчато, образуя ионы водорода (H+), сульфатные ионы (SO4^2-). Этот процесс происходит в водном растворе или в присутствии воды.
2. Кислотность:
Серная кислота является одним из самых сильных неорганических кислот. Она реагирует с основаниями, образуя соль и воду. Также она способна реагировать с многими металлами и образовывать с ними соответствующие соли.
3. Коррозивность:
Серная кислота обладает высокими коррозионными свойствами. Она может разрушать различные материалы, включая металлы, пластик и дерево. Поэтому при работе с ней необходимо соблюдать особые меры предосторожности.
4. Окислительные свойства:
Серная кислота обладает окислительными свойствами и может окислять некоторые вещества. Например, она может окислять серу до серной кислоты или сернистого газа до серной кислоты.
5. Реактивность:
Серная кислота реагирует с многими веществами, образуя различные продукты реакции. Она может реагировать с основаниями, спиртами, эфирами, карбонатами и другими соединениями.
Обратите внимание: Перед использованием серной кислоты необходимо быть осторожным и соблюдать все меры безопасности, так как она является опасным химическим веществом.
Кислотные свойства серной кислоты
Первая ступень диссоциации серной кислоты:
- Начальная концентрация кислоты: H2SO4
- Образующиеся ионы: H+ и HSO4-
Вторая ступень диссоциации серной кислоты:
- Начальная концентрация кислоты: HSO4-
- Образующиеся ионы: H+ и SO42-
При дальнейшей диссоциации серной кислоты образуются ионы водорода (H+) и сульфата (SO42-) в соответствии со степенью кислотности в растворе.
Кислотные свойства серной кислоты определяют ее способность отдавать протоны и взаимодействовать с основаниями для образования солей и воды. Серная кислота также является оксидирующим агентом и может взаимодействовать с другими веществами, вызывая реакции окисления или пропуская ионы через растворы.



